Алкалоиды

Алкало́иды (от лат. alkali — щелочь и др.-греч. εἶδος — вид, облик) — группа азотсодержащих органических соединений природного происхождения (чаще всего растительного), преимущественно гетероциклических, большинство из которых обладает свойствами слабого основания; к ним также причисляются некоторые биогенетически связанные с основными алкалоидами нейтральные[1] и даже слабокислотные соединения[2]. Аминокислоты, нуклеотиды, аминосахара и их полимеры к алкалоидам не относятся. Иногда алкалоидами называются и синтетические соединения аналогичного строения[3].
Помимо углерода, водорода и азота в молекулы алкалоидов могут входить атомы серы, реже — хлора, брома или фосфора[4]. Многие алкалоиды обладают выраженной физиологической активностью[5]. К алкалоидам относятся, например, такие вещества, как морфин, кофеин, кокаин, стрихнин, хинин и никотин.
Граница между алкалоидами и другими азотсодержащими природными соединениями различными авторами проводится по-разному[6]. Иногда считается, что природные соединения, содержащие азот в экзоциклической позиции (мескалин, серотонин, дофамин и др.), относятся к биогенным аминам, но не к алкалоидам[7]. Другие же авторы, напротив, считают алкалоиды частным случаем аминов[8][9] или причисляют биогенные амины к алкалоидам[10].
Название[править | править код]
Название «алкалоиды» (нем. Alkaloide) введено в 1819 году немецким аптекарем Карлом Мейсснером и образовано от позднелат. alkali — «щёлочь» (который, в свою очередь, происходит от арабского al qualja — «пепел растений») и др.-греч. εἶδος — «похожий», «вид». В широкое употребление термин вошёл только после публикации обзорной статьи О. Якобсена в химическом словаре Альберта Ладенбурга[11].
Названия отдельных алкалоидов[править | править код]
Единого метода назначения алкалоидам тривиальных названий не существует[12]. Во многих случаях алкалоидам присваивают названия, образуя индивидуальные названия алкалоидов присоединением суффикса «-ин» к видовым или родовым названиям алкалоидоносов. Например, атропин выделен из растения Белладонна (Atropa belladonna), стрихнин получен из рвотных орешков — семян дерева Чилибуха (Strychnos nux-vomica)[4]. При выделении нескольких алкалоидов из одного растения вместо суффикса «-ин» часто используются суффиксы «-идин», «-анин», «-алин», «-инин» и т. п. Такая практика привела к тому, что существует, например, не менее 86 алкалоидов, содержащих в названии корень «вин» (выделены из барвинка, лат. Vinca)[13].
История[править | править код]
Растения, содержащие алкалоиды, использовались человеком с древнейших времён как в лечебных, так и в рекреационных целях. Так, в Месопотамии лекарственные растения были известны уже за 2000 лет до н. э.[14] В «Одиссее» Гомера упоминается подаренное Елене египетской царицей снадобье, дарящее «забвенье бедствий». Считается, что речь шла о средстве, содержавшем опиум[15]. В I—III веках до н. э. в Китае была написана «Книга домашних растений», в которой упоминалось медицинское использование эфедры и опийного мака[16]. Листья коки использовались индейцами Южной Америки также с древних времён[17].
Экстракты растений, содержащие ядовитые алкалоиды, такие как аконитин и тубокурарин, использовались в древности для изготовления отравленных стрел[14].
Изучение алкалоидов началось в XIX веке. В 1804 году немецкий аптекарь Фридрих Сертюрнер выделил из опиума «снотворный принцип» (лат. principium somniferum), который он назвал «морфием» в честь Морфея, древнегреческого бога сновидений (современное название «морфин» принадлежит французскому физику Гей-Люссаку).
Значительный вклад в химию алкалоидов на заре её развития внесли французские исследователи Пьер Пеллетье и Жозеф Каванту, открывшие, в частности, хинин (1820) и стрихнин (1818). Также в течение нескольких последующих десятилетий были выделены ксантин (1817), атропин (1819), кофеин (1820), кониин (1827), никотин (1828), колхицин (1833), спартеин (1851), кокаин (1860) и другие алкалоиды[18].
Полный синтез алкалоида впервые осуществлён в 1886 г. для кониина немецким химиком Альбертом Ладенбургом путём взаимодействия 2-метилпиридина с ацетальдегидом и восстановления получившегося 2-пропенилпиридина с помощью натрия[19][20].
Появление в XX веке спектроскопии и хроматографии послужило толчком к ускоренному развитию химии алкалоидов. По состоянию на 2008 год известно более 12000 алкалоидов[21].
Классификация[править | править код]

По сравнению с большинством других классов природных соединений класс алкалоидов отличается большим структурным многообразием. Единой классификации алкалоидов не существует[22].
Исторически первые классификации алкалоидов объединяли алкалоиды в группы по признаку происхождения из общего природного источника, например, из растений одного рода. Это было оправдано недостаточностью знаний о химическом строении алкалоидов. В настоящее время такая классификация считается во многом устаревшей[4][23].
Более современные классификации используют объединение алкалоидов в классы по признаку сходства строений углеродного скелета (индольные, изохинолиновые, пиридиновые алкалоиды и т. п.) или по биогенетическим предшественникам (орнитин, лизин, тирозин, триптофан и т. п.)[4] Однако при использовании таких схем также приходится идти на компромиссы в пограничных случаях[22]: так, никотин содержит как пиридиновое ядро, происходящее от никотиновой кислоты, так и пирролидиновое ядро от орнитина[24], и поэтому может быть отнесён к обоим классам[25].
Алкалоиды часто делят на следующие большие группы[26]:
- Алкалоиды с атомом азота в гетероцикле, биогенетическими предшественниками которых являются аминокислоты. Также называются истинными алкалоидами[27]. Примерами истинных алкалоидов являются атропин, никотин, морфин. К этой группе также относят некоторые алкалоиды, содержащие кроме азотистых гетероциклов терпеноидные фрагменты (как эвонин[28]) или имеющие пептидную структуру (как эрготамин[29]). Пиперидиновые алкалоиды кониин и коницеин также часто относят к этой группе[30], но их предшественники не являются аминокислотами[31].
- Алкалоиды с атомом азота в боковой цепи, биогенетическими предшественниками которых являются аминокислоты. Также называются протоалкалоидами[27]. Примерами являются мескалин, адреналин и эфедрин.
- Полиаминные алкалоиды (производные путресцина, спермидина и спермина).
- Пептидные (циклопептидные[32]) алкалоиды.
- Псевдоалкалоиды — соединения, похожие на алкалоиды, биогенетическими предшественниками которых не являются аминокислоты[33]. К этой группе относятся, в первую очередь, терпеноидные и стероидные алкалоиды[34]. Пуриновые алкалоиды, такие как кофеин, теобромин и теофиллин, также иногда относят к псевдоалкалоидам в связи со спецификой их биосинтеза[35]. Некоторые авторы относят к псевдоалкалоидам также такие соединения, как эфедрин и катинон, которые, хотя и происходят от аминокислоты фенилаланина, но атом азота приобретают не от неё, а в результате реакции трансаминации[35][36].
Некоторые соединения, относимые по аналогии к тому или иному структурному классу, не имеют соответствующего элемента углеродного скелета. Так, галантамин и гомоапорфины не содержат изохинолинового ядра, но обычно относятся к изохинолиновым алкалоидам[37].
Основные классы мономерных алкалоидов перечислены в следующей таблице:
| Класс | Основные группы | Основные пути биосинтеза | Представители |
|---|---|---|---|
| Алкалоиды с азотистыми гетероциклами (истинные алкалоиды) | |||
| Производные пирролидина[38] | Орнитин или аргинин → путресцин → N-метилпутресцин → N-метил-Δ1-пирролин[39] | Гигрин, гигролин, кускгигрин, стахидрин[38][40] | |
| Производные тропана[41] | Группа атропина Заместители в позициях 3, 6 или 7 |
Орнитин или аргинин → путресцин → N-метилпутресцин → N-метил-Δ1-пирролин[39] | Атропин, скополамин, гиосциамин[38][41][42] |
| Группа кокаина Заместители в позициях 2 и 3 |
Кокаин, экгонин[41][43] | ||
| Производные пирролизидина[44] | Неэфирные | Орнитин или аргинин → путресцин → гомоспермидин → ретронецин[39] | Ретронецин, гелиотридин, лабурнин[44][45] |
| Сложные эфиры монокарбоновых кислот | Индицин, линделофин, саррацин[44] | ||
| Макроциклические диэфиры | Платифиллин, триходесмин[44] | ||
| Производные пиперидина[46] | Лизин → кадаверин → Δ1-пиперидеин[47] | Седамин, лобелин, анаферин, пиперин[30][48] | |
| Октановая кислота → коницеин → кониин[31] | Кониин, коницеин[31] | ||
| Производные хинолизидина[49][50] | Группа люпинина | Лизин → кадаверин → Δ1-пиперидеин[51] | Люпинин, нуфаридин[49] |
| Группа цитизина | Цитизин[49] | ||
| Группа спартеина | Спартеин, лупанин, анагирин, пахикарпин[49] | ||
| Группа матрина | Матрин, оксиматрин, алломатридин, софоранол[49][52][53] | ||
| Группа ормозанина | Ормозанин, пиптантин[49][54] | ||
| Группа 9b-азафеналена | Гиппоказин, конвергин, кочинеллин[55] | ||
| Группа фенантрохинолизидина | Криптоплеврин, криптоплевридин | ||
| Производные индолизидина[56] | Лизин → δ-полуальдегид α-аминоадипиновой кислоты → пипеколиновая кислота → 1-индолизидинон[57] | Свансонин, кастаноспермин[58] | |
| Производные пиридина[59][60] | Простые производные пиридина | Никотиновая кислота → дигидроникотиновая кислота → 1,2-дигидропиридин[61] | Тригонелин, рицинин, ареколин[59][62] |
| Полициклические неконденсированные производные пиридина | Никотин, норникотин, анабазин, анатабин[59][62] | ||
| Полициклические конденсированные производные пиридина | Актинидин, генцианин, педикулинин[63] | ||
| Сесквитерпеноидные производные пиридина | Никотиновая кислота, изолейцин[10] | Эвонин, гиппократеин, гипоглаунин, триптонин[60][61] | |
| Производные изохинолина и связанные с ними алкалоиды[64] | Простые производные изохинолина[65] | Тирозин или фенилаланин → дофамин, или тирамин (для алкалоидов амариллиса)[66][67] | Корипаллин, сальсолин, лофоцерин[64][65] |
| Производные 1- и 3-изохинолонов[68] | N-метилкоридальдин, нороксигидрастинин[68] | ||
| Производные 1- и 4-фенилтетрагидроизохинолинов[65] | Криптостилин, хериллин[65][69] | ||
| Производные 5-нафтилизохинолина[70] | Анцистрокладин, гаматин[70] | ||
| Производные 1- и 2-бензилизохинолинов[71] | Папаверин, лауданозин, сендаверин | ||
| Группа куларина[72] | Куларин, ягонин[72] | ||
| Павины и изопавины[73] | Аргемонин, амуренсин[73] | ||
| Бензопирроколины[74] | Криптаустолин[65] | ||
| Протоберберины[65] | Берберин, канадин, офиокарпин, мекамбридин, коридалин[75] | ||
| Фталидизохинолины[65] | Гидрастин, наркотин (носкапин)[76] | ||
| Спиробензилизохинолины[65] | Фумарицин, охотенсин[73] | ||
| Алкалоиды ипекакуаны[77] | Эметин, протоэметин, ипекозид[77] | ||
| Бензофенантридины[65] | Сангвинарин, оксинитидин, коринолоксин[78] | ||
| Апорфины[65] | Глауцин, коридин, лириоденин[79] | ||
| Проапорфины[65] | Пронуциферин, глазиовин[65][74] | ||
| Гомоапорфины[80] | Крейсигин, мультифлорамин[80] | ||
| Гомопроапорфины[80] | Бульбокодин[72] | ||
| Группа морфина[81] | Морфин, кодеин, тебаин, синоменин[82] | ||
| Гомоморфины[83] | Крейсигинин, андроцимбин[81] | ||
| Трополоизохинолины[65] | Имерубрин[65] | ||
| Азофлуорантены[65] | Руфесцин, имелутеин[84] | ||
| Алкалоиды амариллиса[85] | Ликорин, амбеллин, гиппеастрин, тазеттин, галантамин, монтанин[86] | ||
| Алкалоиды эритрины[69] | Эризодин, эритроидин[69] | ||
| Производные фенантрена[65] | Атеросперминин, таликтуберин[65][75] | ||
| Протопины[65] | Протопин, оксомурамин, корикавидин[78] | ||
| Аристолактамы[65] | Дорифлавин[65] | ||
| Производные оксазола[87] | Тирозин → тирамин[88] | Аннулолин, галфординол, тексалин, тексамин[89] | |
| Производные тиазола[90] | 1-деокси-D-ксилулозы-5-фосфат (DOXP), тирозин, цистеин[91] | Аргохелин, ностоцикламид, тиострептон[90][92] | |
| Производные хиназолина[93] | Производные 3,4-дигидро-4-хиназолона | Антраниловая кислота или фенилаланин или орнитин[94] | Фебрифугин[95] |
| Производные 1,4-дигидро-4-хиназолона | Гликорин, арборин (гликозин), гликозминин[95] | ||
| Производные пирролидино- и пиперидинохиназолинов | Вазицин (пеганин)[87] | ||
| Производные акридина[87] | Антраниловая кислота[96] | Рутакридон, акроницин, эвоксантин[97][98] | |
| Производные хинолина[99][100] | Простые производные хинолина, производные 2-хинолона и 4-хинолона | Антраниловая кислота → 3-карбоксихинолин[101] | Куспарин, эхинопсин, эвокарпин[100][102][103] |
| Трициклические терпеноиды | Флиндерсин[100][104] | ||
| Производные фуранохинолина | Диктамнин, фагарин, скиммианин[100][105][106] | ||
| Группа хинина | Триптофан → триптамин → стриктозидин (с участием секологанина) → коринантеал → цинхонинон[67][101] | Хинин, хинидин, цинхонин, цинхонидин[104] | |
Производные индола[82]
|
Неизопреноидные индольные алкалоиды | ||
| Простые производные индола[107] | Триптофан → триптамин или 5-гидрокситриптофан[108] | Серотонин, псилоцибин, диметилтриптамин (ДМТ), буфотенин[109][110] | |
| Простые производные β-карболина[111] | Гарман, гармин, гармалин, элеагнин[107] | ||
| Пирролоиндольные алкалоиды[112] | Физостигмин (эзерин), эзерамин, физовенин, эптастигмин[112] | ||
| Гемитерпеноидные индольные алкалоиды | |||
| Алкалоиды спорыньи (эргоалкалоиды)[82] | Триптофан → ханоклавин → агроклавин → элимоклавин → паспаловая кислота → лизергиновая кислота[112] | Эрготамин, эргобазин, эргозин[113] | |
| Монотерпеноидные индольные алкалоиды | |||
| Алкалоиды типа Corynanthe[108] | Триптофан → триптамин → стриктозидин (с участием секологанина)[108] | Аймалицин, сарпагин, вобазин, аймалин, акуаммилин, йохимбин, резерпин, митрагинин[114][115], группа стрихнина (Стрихнин, бруцин, акуамицин, вомицин[116]) | |
| Алкалоиды типа Iboga[108] | Ибогамин, ибогаин, воакангин[108] | ||
| Алкалоиды типа Aspidosperma[108] | Винкамин, винкотин, аспидоспермин, квебрахамин[117][118] | ||
| Производные имидазола[87] | Напрямую из гистидина[119] | Гистамин, пилокарпин, долихотелин, пилозин, стивенсин[87][119] | |
| Производные пурина[120] | Ксантозин (образуемый в процессе пуринового биосинтеза) → 7-метилксантозин → 7-метилксантин → теобромин → кофеин[67] | Кофеин, теобромин, теофиллин, сакситоксин[121][122] | |
| Алкалоиды с азотом в боковой цепи (протоалкалоиды) | |||
| Производные β-фенилэтиламина[74] | Тирозин или фенилаланин → диоксифенилаланин → дофамин → адреналин и мескалин; тирозин → тирамин; фенилаланин → 1-фенилпропан-1,2-дион → катинон → эфедрин и псевдоэфедрин[10][36][123] | Тирамин, горденин, эфедрин, псевдоэфедрин, мескалин, катинон, катехоламины (адреналин, норадреналин, дофамин)[10][124] | |
| Колхициновые алкалоиды[125] | Тирозин или фенилаланин → дофамин → аутумналин → колхицин[126] | Колхицин, колхамин[125] | |
| Мускарины[127] | Глутаминовая кислота → 3-кетоглутаминовая кислота → мускарины (с участием пировиноградной кислоты)[128] | Мускарин, алломускарин, эпимускарин, эпиалломускарин[127] | |
| Бензиламины[129] | Фенилаланин, с участием валина, лейцина или изолейцина[130] | Капсаицин, дигидрокапсаицин, нордигидрокапсаицин[129][131] | |
| Полиаминные алкалоиды | |||
| Производные путресцина[132] | Орнитин → путресцин → спермидин → спермин[133] | Пауцин[132] | |
| Производные спермидина[132] | Инаденин-12-он, лунарин, кодонокарпин[132] | ||
| Производные спермина[132] | Вербасценин, афеландрин[132] | ||
| Пептидные (циклопептидные) алкалоиды | |||
| Пептидные алкалоиды с 13-членным циклом[32][134] | Тип нумуларина C | Из различных аминокислот[32] | Нумуларин C, нумуларин S[32] |
| Тип зизифина A | Зизифин A, сативанин H[32] | ||
| Пептидные алкалоиды с 14-членным циклом[32][134] | Тип франгуланина | Франгуланин, скутианин J[134] | |
| Тип скутианина A | Скутианин A[32] | ||
| Тип интегеррина | Интегеррин, дискарин D[134] | ||
| Тип амфибина F | Амфибин F, спинанин A[32] | ||
| Тип амфибина B | Амфибин B, лотузин C[32] | ||
| Пептидные алкалоиды с 15-членным циклом[134] | Тип мукронина A | Мукронин A[29][134] | |
| Псевдоалкалоиды (терпены и стероиды) | |||
| Дитерпены[29] | Тип ликоктонина | Мевалоновая кислота → изопентенилпирофосфат → геранилпирофосфат[135][136] | Аконитин, дельфинин[29][137] |
| Тип гетератизина | Гетератизин[29] | ||
| Тип атизина | Атизин[29] | ||
| Тип веатхина | Веатхин[29] | ||
| Стероидные алкалоиды[138] | Холестерин, аргинин[139] | Соласодин, соланидин, вералкамин[140] | |
Свойства[править | править код]
Алкалоиды, молекулы которых содержат атомы кислорода (что справедливо для подавляющего большинства алкалоидов) при стандартных условиях, как правило, представляют собой бесцветные кристаллы. Алкалоиды, молекулы которых не содержат атомов кислорода, чаще всего являются летучими бесцветными маслянистыми жидкостями[141] (как никотин[142] или кониин[19]). Некоторые алкалоиды не являются бесцветными: так, берберин жёлтый, сангвинарин оранжевый[141].
Большинство алкалоидов обладает свойствами слабых оснований, но некоторые из них амфотерны (как теобромин и теофиллин)[143].
Как правило, алкалоиды плохо растворимы в воде, но хорошо растворимы во многих органических растворителях (диэтиловом эфире, хлороформе и 1,2-дихлорэтане). Исключением является, например, кофеин, хорошо растворимый в кипящей воде[143]. При взаимодействии с кислотами алкалоиды образуют соли различной степени прочности. Соли алкалоидов, как правило, хорошо растворимы в воде и спиртах и плохо растворимы в большинстве органических растворителей, хотя известны соли, плохо растворимые в воде (сульфат хинина) и хорошо растворимые в органических растворителях (гидробромид скополамина)[141].
Большинство алкалоидов имеет горький вкус. Предполагается, что таким образом естественный отбор защитил животных от вырабатываемых растениями алкалоидов, многие из которых сильно ядовиты[144].
Распространение в природе[править | править код]
Алкалоиды синтезируются различными живыми организмами. Наиболее широко они распространены в высших растениях: по имеющимся оценкам, от 10 до 25 % видов высших растений содержат алкалоиды[145][146]. Характерно, что в прошлом термин «алкалоид» чаще всего применялся только по отношению к веществам растительного происхождения[5].
Содержание алкалоидов в растениях, как правило, не превышает нескольких процентов. Обычно концентрация невелика и составляет сотые и десятые доли процента. При содержании 1—3 % растение считается богатым алкалоидами (высокоалкалоидоносным). Только немногие растения, например, культивируемые формы хинного дерева, содержат до 15—20 % алкалоидов. Особенно богаты алкалоидами растения таких семейств, как Маковые, Паслёновые, Бобовые, Кутровые, Мареновые, Лютиковые, Логаниевые. В водорослях, грибах, мхах, папоротниках и голосеменных они встречаются сравнительно редко[147]. В большинстве растений распределение алкалоидов по тканям неравномерно. В зависимости от вида растения максимальное содержание алкалоидов может достигаться в листьях (белена чёрная), плодах или семенах (чилибуха), корнях (раувольфия змеиная) или коре (хинное дерево)[148]. В растениях алкалоиды находятся в виде солей органических и неорганических кислот в активно растущих тканях, эпидермальных и гиподермальных клетках, в обкладках сосудистых пучков и латексных ходах. Они растворены в клеточном соке[147]. Кроме того, в разных тканях одного и того же растения могут содержаться разные алкалоиды[149], например, катарантус розовый содержит более 60 алкалоидов[147].
Помимо растений, алкалоиды содержатся в некоторых видах грибов (псилоцибин, содержащийся в грибах рода псилоцибе) и животных (буфотенин, содержащийся в коже некоторых жаб)[12]. Биогенные амины, такие как адреналин или серотонин, играющие важную роль в организмах высших животных, сходны с алкалоидами по строению и путям биосинтеза и иногда также называются алкалоидами[150].
Кроме того, алкалоиды содержатся во многих морских организмах[151].
Извлечение[править | править код]
Ввиду большого структурного разнообразия алкалоидов не существует единого метода выделения их из природного сырья[152]. Большинство методов основаны на использовании того факта, что основания алкалоидов, как правило, хорошо растворимы в органических растворителях и плохо растворимы в воде, а соли — наоборот.
Большинство растений содержат несколько алкалоидов. При выделении алкалоидов из природного сырья сначала производится извлечение смеси алкалоидов, а затем выделение индивидуальных алкалоидов из смеси[153].
Перед извлечением алкалоидов растительное сырьё тщательно измельчается[152][154].
Чаще всего алкалоиды находятся в растительном сырье в виде солей органических кислот[152]. При этом извлечены алкалоиды могут быть как в виде оснований, так и в виде солей[153].
При извлечении алкалоидов в виде оснований сырьё обрабатывается щелочными растворами для перевода солей алкалоидов в основания, после чего основания алкалоидов извлекаются органическими растворителями (1,2-дихлорэтан, хлороформ, диэтиловый эфир, бензол). Затем для очистки от примесей полученный раствор оснований алкалоидов обрабатывается слабым раствором кислоты, при этом алкалоиды образуют соли, нерастворимые в органических растворителях и переходящие в воду. При необходимости водный раствор солей алкалоидов снова подщелачивают и обрабатывают органическим растворителем. Процесс продолжается, пока не получен раствор смеси алкалоидов достаточной чистоты.
При извлечении алкалоидов в виде солей сырьё обрабатывается слабым раствором кислоты (например, уксусной) в воде, этаноле или метаноле. Полученный раствор подщелачивают для перевода солей алкалоидов в основания, которые извлекаются органическим растворителем (если экстракция производилась с помощью спирта, его предварительно необходимо отогнать, а остаток растворить в воде). Раствор оснований алкалоидов в органическом растворителе подвергается очистке, как указано выше[152][155].
Разделение смеси алкалоидов на компоненты производится с использованием различия их физических и химических свойств. Для этого может быть использована перегонка, разделение на основе различной растворимости алкалоидов в конкретном растворителе, разделение на основе различия в силе основности и разделение путём получения производных[156].
Биосинтез[править | править код]
Биогенетическими предшественниками большинства алкалоидов являются аминокислоты: орнитин, лизин, фенилаланин, тирозин, триптофан, гистидин, аспарагиновая кислота и антраниловая кислота. Все эти аминокислоты, кроме антраниловой кислоты, являются протеиногенными[157]. Никотиновая кислота может быть синтезирована из триптофана или аспарагиновой кислоты. Пути биосинтеза алкалоидов не менее разнообразны, чем их структуры, и их невозможно объединить в общую схему[67]. Тем не менее, существует несколько характерных реакций, участвующих в биосинтезе различных классов алкалоидов[157]:
- образование оснований Шиффа,
- реакция Манниха,
Образование оснований Шиффа[править | править код]
Основания Шиффа могут быть получены в результате реакции аминов с кетонами или альдегидами[158]. Данная реакция является распространённым способом формирования C=N связи[159].
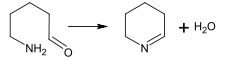
При биосинтезе алкалоидов реакция образования основания может проходить также внутримолекулярно[157]. Примером может являться реакция образования Δ1-пиперидеина, происходящая при синтезе пиперидинового цикла[25]:
Реакция Манниха[править | править код]
В реакции Манниха, помимо амина и карбонильного соединения, участвует также карбанион, играющий роль нуклеофила в процессе присоединения к иону, образованному взаимодействием амина и карбонильного соединения[159].
Реакция Манниха также может осуществляться как межмолекулярно, так и внутримолекулярно[160]. Примером внутримолекулярной реакции Манниха может служить синтез пирролизидинового ядра[161]:
Разновидностью внутримолекулярной реакции Манниха является реакция Пикте — Шпенглера — циклизация шиффовых оснований, образованных из β-фенилэтиламинов с образованием системы тетрагидроизохинолина. У растений биосинтез алкалоидов происходит всегда под действием ферментов, у животных же известны случаи неферментативного синтеза изохинолиновых алкалоидов, включающий две последовательные стадии — образование основание Шиффа из катехоламинов и альдегида и реакцию Пикте — Шпенглера. Обе эти реакции могут протекать в физиологических условиях и в отсутствии ферментов. Обычно неферментативный синтез алкалоидов происходит при нарушениях обмена веществ или интоксикациях, когда в организме имеется избыток аминов или альдегидов. Так, высокий уровень катехоламинов в мозгу человека наблюдается при шизофрении, паркинсонизме. Сопутствующие этим заболеваниям нарушения психики отчасти связывают с неферментативным синтезом изохинолиновых алкалоидов. В результате приёма алкоголя из дофамина и ацетальдегида образуется алкалоид салсолинол, который является одним из факторов развития алкогольной зависимости. [162]
Димерные алкалоиды[править | править код]
Помимо описанных выше мономерных алкалоидов, существует также некоторое количество димерных (реже — тримерных, значительно реже — тетрамерных) алкалоидов, образующихся в процессе конденсации двух (трёх, четырёх) мономерных алкалоидов. Как правило, димерные алкалоиды являются результатом конденсации двух алкалоидов одинакового типа. Наиболее распространены бисиндольные алкалоиды и димерные изохинолиновые алкалоиды. Основные механизмы димеризации алкалоидов[163]:
- Реакция Манниха. Примером является бисиндольный алкалоид воакамин.
- Реакция Михаэля — виллальстонин.
- конденсация альдегидов с аминами — токсиферин.
- Окислительное сочетание фенолов — даурицин, тубокурарин.
- Лактонизация — карпаин.
Биологическая роль[править | править код]
Значение алкалоидов для живых организмов, их синтезирующих, до сих пор изучено недостаточно[164]. Первоначально предполагалось, что алкалоиды являются конечными продуктами метаболизма азота у растений, как мочевина у млекопитающих. Позднее было показано, что во многих растениях содержание алкалоидов может как увеличиваться, так и уменьшаться с течением времени; таким образом, эта гипотеза была опровергнута[6].
Большинство известных функций алкалоидов относятся к защите растений от внешних воздействий. Так, например, апорфиновый алкалоид лириоденин, вырабатываемый лириодендроном тюльпановым, защищает растение от паразитических грибов. Кроме того, содержание алкалоидов в растении препятствует их поеданию насекомыми и растительноядными хордовыми, хотя животные, в свою очередь, выработали способы противодействия токсичному действию алкалоидов; некоторые из них даже используют алкалоиды в собственном метаболизме[165].
Алкалоиды имеют и эндогенное значение. Такие вещества, как серотонин, дофамин и гистамин, иногда также относимые к алкалоидам, являются важными нейромедиаторами у животных. Известна также роль алкалоидов в регулировке роста растений[166].
Применение[править | править код]
В медицине[править | править код]
Медицинское применение растений-алкалоидоносов имеет давнюю историю. В XIX веке, когда первые алкалоиды были получены в чистом виде, они сразу нашли своё применение в клинической практике в качестве лекарственного средства.[167] Многие алкалоиды до сих пор применяются в медицине (чаще в виде солей), например:[6][168]
| Алкалоид | Фармакологическое действие |
|---|---|
| Аймалин | антиаритмическое |
| Атропин, скополамин, гиосциамин | антихолинергические препараты |
| Винбластин, винкристин | противоопухолевое |
| Винкамин | сосудорасширяющее, антигипертензивное |
| Кодеин | противокашлевое средство |
| Кокаин | анестетик |
| Колхицин | средство от подагры |
| Морфин | наркотический анальгетик |
| Резерпин | антигипертензивное |
| Тубокурарин | миорелаксант |
| Физостигмин | ингибитор ацетилхолинэстеразы |
| Хинидин | антиаритмическое |
| Хинин | антипиретическое, противомалярийное |
| Эметин | рвотное, антипротозойное |
| Эргоалкалоиды | симпатомиметическое, сосудорасширяющее, антигипертензивное |
Многие синтетические и полусинтетические препараты являются структурными модификациями алкалоидов, разработанными с целью усилить или изменить основное действие препарата и ослабить нежелательные побочные эффекты.[169] Так, например, налоксон, антагонист опиоидных рецепторов, является производным содержащегося в опиуме алкалоида тебаина:[170]
Cхематично по спектру действия алкалоиды делят на следующие группы:
- транквилизирующие ЦНС;
- стимулирующие ЦНС;
- гипертензивные;
- гипотензивные;
- сосудосуживающие;
- сосудорасширяющие;
- влияющие на медиаторы;
- влияющие на функциональное состояние мышечной системы.[171]
Применение в сельском хозяйстве[править | править код]
До разработки широкой гаммы относительно малотоксичных синтетических пестицидов некоторые алкалоиды достаточно широко применялись в качестве инсектицидов (соли никотина и анабазина). Их применение было ограничено высокой токсичностью для людей[172].
Психостимулирующее и наркотическое использование[править | править код]
Многие алкалоиды являются психоактивными веществами. Препараты растений, содержащих алкалоиды, их экстракты, а позже и чистые препараты алкалоидов использовались в качестве стимулирующего и/или наркотического средства. Кокаин и катинон являются стимуляторами центральной нервной системы[173][174]. Мескалин и многие индольные алкалоиды (такие как псилоцибин, диметилтриптамин, ибогаин) обладают галлюциногенным эффектом[175][176]. Морфин и кодеин — сильные наркотические обезболивающие[177].
Кроме того, существуют алкалоиды, не обладающие сильным психоактивным действием, но являющиеся прекурсорами для полусинтетических психоактивных веществ. Например, из эфедрина и псевдоэфедрина синтезируются меткатинон (эфедрон) и метамфетамин[178].
Примечания[править | править код]
- ↑ alkaloids // IUPAC. Compendium of Chemical Terminology, 2nd ed. (the «Gold Book»). Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). XML on-line corrected version: http://goldbook.iupac.org (2006-) created by M. Nic, J. Jirat, B. Kosata; updates compiled by A. Jenkins. ISBN 0-9678550-9-8. doi:10.1351/goldbook
- ↑ R. H. F. Manske. The Alkaloids. Chemistry and Physiology. Volume VIII. — New York: Academic Press, 1965. — p. 673.
- ↑ Robert Alan Lewis. Lewis’ dictionary of toxicology. CRC, 1998. — p. 51.
- ↑ а б в г Химическая энциклопедия: Алкалоиды
- ↑ а б Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 4.
- ↑ а б в Robert A. Meyers. Encyclopedia of Physical Science and Technology, Eighteen-Volume Set, Third Edition. — Alkaloids.
- ↑ Leland J. Cseke et al. Natural Products from Plants. Second Edition. — CRC, 2006. — p. 30.
- ↑ A. William Johnson. Invitation to Organic Chemistry. — Jones and Bartlett, 1999. — p. 433.
- ↑ Raj K Bansal. A Text Book of Organic Chemistry. 4th Edition. — New Age International, 2004. — p. 644.
- ↑ а б в г Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: 2007. — p. 110
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 1—3.
- ↑ а б Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 5.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 7.
- ↑ а б Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: 2007. — p. 182
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 338.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 304.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 350.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 313—316.
- ↑ а б БСЭ: Кониин
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 204.
- ↑ Tadhg P. Begley. Encyclopedia of Chemical Biology: Natural Products in Plants, Chemical Diversity of.
- ↑ а б Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 11.
- ↑ Орехов А. П. Химия алкалоидов. — Изд. 2. — М.: АН СССР, 1955. — с. 6.
- ↑ Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: 2007. — p. 109.
- ↑ а б Paul M Dewick. Medicinal Natural Products. A Biosynthetic Approach. Second Edition. — Wiley, 2002. — p. 307.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 12.
- ↑ а б Племенков В. В. Введение в химию природных соединений. — Казань: 2001. — с. 223.
- ↑ Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: 2007. — p. 108.
- ↑ а б в г д е ё Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 84.
- ↑ а б Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 31.
- ↑ а б в Paul M Dewick. Medicinal Natural Products. A Biosynthetic Approach. Second Edition. — Wiley, 2002. — p. 381.
- ↑ а б в г д е ё ж з Dimitris C. Gournelif, Gregory G. Laskarisb and Robert Verpoorte. «Cyclopeptide alkaloids» // Nat. Prod. Rep. — 1997. — № 14. — С. 75—82.
- ↑ Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: 2007. — p. 11.
- ↑ Племенков В. В. Введение в химию природных соединений. — Казань: 2001. — с. 246.
- ↑ а б Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: 2007. — p. 12.
- ↑ а б Paul M Dewick. Medicinal Natural Products. A Biosynthetic Approach. Second Edition. — Wiley, 2002. — p. 382.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — pp. 44, 53.
- ↑ а б в Племенков В. В. Введение в химию природных соединений. — Казань: 2001. — с. 224.
- ↑ а б в Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: 2007. — p. 75.
- ↑ Орехов А. П. Химия алкалоидов. — Изд. 2. — М.: АН СССР, 1955. — с. 33.
- ↑ а б в Химическая энциклопедия: Тропановые алкалоиды.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 34.
- ↑ Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: 2007. — p. 27.
- ↑ а б в г Химическая энциклопедия: Пирролизидиновые алкалоиды.
- ↑ Племенков В. В. Введение в химию природных соединений. — Казань: 2001. — с. 229.
- ↑ Племенков В. В. Введение в химию природных соединений. — Казань: 2001. — с. 225.
- ↑ Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: 2007. — p. 95.
- ↑ Орехов А. П. Химия алкалоидов. — Изд. 2. — М.: АН СССР, 1955. — с. 80.
- ↑ а б в г д е Химическая энциклопедия: Хинолизидиновые алкалоиды.
- ↑ J. E. Saxton. The Alkaloids. A Specialist Periodical Report. Volume 1. — London: The Chemical Society, 1971. — p. 93.
- ↑ Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: 2007. — p. 98.
- ↑ J. E. Saxton. The Alkaloids. A Specialist Periodical Report. Volume 1. — London: The Chemical Society, 1971. — p. 91.
- ↑ Joseph P. Michael. «Indolizidine and quinolizidine alkaloids» // Nat. Prod. Rep. — 2002. — № 19. — С. 458—475.
- ↑ J. E. Saxton. The Alkaloids. A Specialist Periodical Report. Volume 1. — London: The Chemical Society, 1971. — p. 92.
- ↑ Joseph P. Michael. «Indolizidine and quinolizidine alkaloids» // Nat. Prod. Rep. — 1999. — № 16. — С. 675—696.
- ↑ Paul M Dewick. Medicinal Natural Products. A Biosynthetic Approach. Second Edition. — Wiley, 2002. — p. 310.
- ↑ Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: 2007. — p. 96.
- ↑ Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: 2007. — p. 97.
- ↑ а б в Племенков В. В. Введение в химию природных соединений. — Казань: 2001. — с. 227.
- ↑ а б Химическая энциклопедия: Пиридиновые алкалоиды.
- ↑ а б Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: 2007. — p. 107.
- ↑ а б Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: 2007. — p. 85.
- ↑ Племенков В. В. Введение в химию природных соединений. — Казань: 2001. — с. 228.
- ↑ а б Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 36.
- ↑ а б в г д е ё ж з и й к л м н о п р с т Химическая энциклопедия: Изохинолиновые алкалоиды
- ↑ Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: 2007. — pp. 77—78.
- ↑ а б в г Tadhg P. Begley. Encyclopedia of Chemical Biology: Alkaloid Biosynthesis
- ↑ а б J. E. Saxton. The Alkaloids. A Specialist Periodical Report. Volume 3. — London: The Chemical Society, 1973. — p. 122.
- ↑ а б в Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 54.
- ↑ а б Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 37.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 38.
- ↑ а б в Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 46.
- ↑ а б в Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 50.
- ↑ а б в Kenneth W. Bentley. «β-Phenylethylamines and the isoquinoline alkaloids» // Nat. Prod. Rep. — 1997. — № 14. — С. 387—411.
- ↑ а б Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 47.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 39.
- ↑ а б Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 41.
- ↑ а б Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 49.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 44.
- ↑ а б в J. E. Saxton. The Alkaloids. A Specialist Periodical Report. Volume 3. — London: The Chemical Society, 1973. — p. 164.
- ↑ а б Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 51.
- ↑ а б в Племенков В. В. Введение в химию природных соединений. — Казань: 2001. — с. 236.
- ↑ J. E. Saxton. The Alkaloids. A Specialist Periodical Report. Volume 3. — London: The Chemical Society, 1973. — p. 163.
- ↑ J. E. Saxton. The Alkaloids. A Specialist Periodical Report. Volume 3. — London: The Chemical Society, 1973. — p. 168.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 52.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 53.
- ↑ а б в г д Племенков В. В. Введение в химию природных соединений. — Казань: 2001. — с. 241
- ↑ Arnold Brossi. The Alkaloids: Chemistry and Pharmacology, Volume 35. — Academic Press, 1989. — p. 261.
- ↑ Arnold Brossi. The Alkaloids: Chemistry and Pharmacology, Volume 35. — Academic Press, 1989. — pp. 260—263.
- ↑ а б Племенков В. В. Введение в химию природных соединений. — Казань: 2001. — с. 242.
- ↑ Tadhg P. Begley. Encyclopedia of Chemical Biology: Cofactor Biosynthesis.
- ↑ John R. Lewis. «Amaryllidaceae, muscarine, imidazole, oxazole, thiazole and peptide alkaloids, and other miscellaneous alkaloids» // Nat. Prod. Rep. — 2000. — № 17. — С. 57—84.
- ↑ Химическая энциклопедия: Хиназолиновые алкалоиды.
- ↑ Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: 2007. — p. 106.
- ↑ а б Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: 2007. — p. 105.
- ↑ Richard B. Herbert. «The biosynthesis of plant alkaloids and nitrogenous microbial metabolites» // Nat. Prod. Rep. — 1999. — № 16. — С. 199—208.
- ↑ Племенков В. В. Введение в химию природных соединений. — Казань: 2001. — с. 231, 246.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 58.
- ↑ Племенков В. В. Введение в химию природных соединений. — Казань: 2001. — с. 231.
- ↑ а б в г Химическая энциклопедия: Хинолиновые алкалоиды.
- ↑ а б Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: 2007. — p. 114.
- ↑ Орехов А. П. Химия алкалоидов. — Изд. 2. — М.: АН СССР, 1955. — с. 205.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 55.
- ↑ а б Племенков В. В. Введение в химию природных соединений. — Казань: 2001. — с. 232.
- ↑ Орехов А. П. Химия алкалоидов. — Изд. 2. — М.: АН СССР, 1955. — с. 212.
- ↑ Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: 2007. — p. 118.
- ↑ а б Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: 2007. — p. 112.
- ↑ а б в г д е Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: 2007. — p. 113.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 15.
- ↑ J. E. Saxton. The Alkaloids. A Specialist Periodical Report. Volume 1. — London: The Chemical Society, 1971. — p. 467.
- ↑ Paul M Dewick. Medicinal Natural Products. A Biosynthetic Approach. Second Edition. — Wiley, 2002. — p. 349—350.
- ↑ а б в Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: 2007. — p. 119.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 29.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — pp. 23—26.
- ↑ J. E. Saxton. The Alkaloids. A Specialist Periodical Report. Volume 1. — London: The Chemical Society, 1971. — p. 169.
- ↑ J. E. Saxton. The Alkaloids. A Specialist Periodical Report. Volume 5. — London: The Chemical Society, 1975. — p. 210.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — pp. 17—18.
- ↑ Paul M Dewick. Medicinal Natural Products. A Biosynthetic Approach. Second Edition. — Wiley, 2002. — p. 357.
- ↑ а б Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: 2007. — p. 104
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 72.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 73.
- ↑ Paul M Dewick. Medicinal Natural Products. A Biosynthetic Approach. Second Edition. — Wiley, 2002. — p. 396.
- ↑ PlantCyc Pathway: ephedrine biosynthesis.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 76.
- ↑ а б Химическая энциклопедия: Колхициновые алкалоиды.
- ↑ Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: 2007. — p. 77.
- ↑ а б Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 81.
- ↑ Arnold Brossi. The Alkaloids: Chemistry and Pharmacology, Volume 23. — Academic Press, 1984. — p. 376.
- ↑ а б Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 77.
- ↑ Arnold Brossi. The Alkaloids: Chemistry and Pharmacology, Volume 23. — Academic Press, 1984. — p. 268.
- ↑ Arnold Brossi. The Alkaloids: Chemistry and Pharmacology, Volume 23. — Academic Press, 1984. — p. 231.
- ↑ а б в г д е Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 82.
- ↑ Spermine Biosynthesis.
- ↑ а б в г д е Племенков В. В. Введение в химию природных соединений. — Казань: 2001. — с. 243.
- ↑ Химическая энциклопедия: Терпены.
- ↑ Tadhg P. Begley. Encyclopedia of Chemical Biology: Natural Products: An Overview.
- ↑ Atta-ur-Rahman and M. Iqbal Choudhary. «Diterpenoid and steroidal alkaloids» // Nat. Prod. Rep. — 1997. — № 14. — С. 191—203.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 88.
- ↑ Paul M Dewick. Medicinal Natural Products. A Biosynthetic Approach. Second Edition. — Wiley, 2002. — p. 388.
- ↑ Племенков В. В. Введение в химию природных соединений. — Казань: 2001. — с. 247.
- ↑ а б в Гринкевич Н. И., Сафронич Л. Н. Химический анализ лекарственных растений: Учеб. пособие для фармацевтических вузов. — М.: 1983. — с. 131.
- ↑ БСЭ: Никотин.
- ↑ а б G. A. Spiller. Caffeine. — USA: CRC Press, 1997. — INTRODUCTION TO THE CHEMISTRY, ISOLATION, AND BIOSYNTHESIS OF METHYLXANTHINES.
- ↑ E. Fattorusso and O. Taglialatela-Scafati. Modern Alkaloids: Structure, Isolation, Synthesis and Biology. — Wiley-VCH, 2008. — p. 53.
- ↑ Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: 2007. — p. 13.
- ↑ Орехов А. П. Химия алкалоидов. — Изд. 2. — М.: АН СССР, 1955. — с. 11.
- ↑ а б в Блинова К. Ф. и др. Ботанико-фармакогностический словарь: Справ. пособие. — М.: Высш. шк., 1990. — С. 8. — ISBN 5-06-000085-0о книге
- ↑ Гринкевич Н. И., Сафронич Л. Н. Химический анализ лекарственных растений: Учеб. пособие для фармацевтических вузов. — М.: 1983. — с. 122—123.
- ↑ Орехов А. П. Химия алкалоидов. — Изд. 2. — М.: АН СССР, 1955. — с. 12.
- ↑ Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: 2007. — p. 110—111.
- ↑ E. Fattorusso and O. Taglialatela-Scafati. Modern Alkaloids: Structure, Isolation, Synthesis and Biology. — Wiley-VCH, 2008. — p. XVII.
- ↑ а б в г Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 116.
- ↑ а б Гринкевич Н. И., Сафронич Л. Н. Химический анализ лекарственных растений: Учеб. пособие для фармацевтических вузов. — М.: 1983. — с. 132.
- ↑ Гринкевич Н. И., Сафронич Л. Н. Химический анализ лекарственных растений: Учеб. пособие для фармацевтических вузов. — М.: 1983. — с. 5.
- ↑ Гринкевич Н. И., Сафронич Л. Н. Химический анализ лекарственных растений: Учеб. пособие для фармацевтических вузов. — М.: 1983. — с. 132—134.
- ↑ Гринкевич Н. И., Сафронич Л. Н. Химический анализ лекарственных растений: Учеб. пособие для фармацевтических вузов. — М.: 1983. — с. 134—136.
- ↑ а б в Племенков В. В. Введение в химию природных соединений. — Казань: 2001. — с. 253.
- ↑ Племенков В. В. Введение в химию природных соединений. — Казань: 2001. — с. 254.
- ↑ а б Paul M Dewick. Medicinal Natural Products. A Biosynthetic Approach. Second Edition. — Wiley, 2002. — p. 19.
- ↑ Племенков В. В. Введение в химию природных соединений. — Казань: 2001. — с. 255.
- ↑ Paul M Dewick. Medicinal Natural Products. A Biosynthetic Approach. Second Edition. — Wiley, 2002. — p. 305.
- ↑ Основы ХПС, 2009, с. 80—81
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 91—105.
- ↑ Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: 2007. — p. 142.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 283—291.
- ↑ Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: 2007. — p. 142—143.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 303.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 303—309.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 309.
- ↑ Paul M Dewick. Medicinal Natural Products. A Biosynthetic Approach. Second Edition. — Wiley, 2002. — p. 335.
- ↑ Гончарова Т. А. Энциклопедия лекарственных растений. — М.: Издательский Дом МСП, 1997. Т. 1: [А-Р]. — 559 с. ISBN 5-7578-0024-0 Т. 2: [С-Я]. — 528 с. ISBN 5-7578-0025-9
- ↑ György Matolcsy, Miklós Nádasy, Viktor Andriska. Pesticide chemistry. — Elsevier, 2002. — p. 21—22.
- ↑ Н. В. Веселовская, А. Е. Коваленко. Наркотики. — М.: Триада-X, 2000. — с. 75.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 79.
- ↑ Н. В. Веселовская, А. Е. Коваленко. Наркотики. — М.: Триада-X, 2000. — с. 136.
- ↑ Geoffrey A. Cordell. The Alkaloids: Chemistry and Biology. Volume 56. — Elsevier, 2001. — p. 8.
- ↑ Н. В. Веселовская, А. Е. Коваленко. Наркотики. — М.: Триада-X, 2000. — с. 6.
- ↑ Н. В. Веселовская, А. Е. Коваленко. Наркотики. — М.: Триада-X, 2000. — с. 51—52.
Литература[править | править код]
- Орехов А. П. Химия алкалоидов. — Изд. 2. — М.: АН СССР, 1955. — 859 с.о книге
- Кнунянц И. Л. Химическая энциклопедия. — М.: Советская энциклопедия, 1988. — С. 83. — 623 с.о книге
- Племенков В. В. Введение в химию природных соединений. — Казань: 2001. — 376 с.о книге
- Семёнов А. А., Карцев В. Г. Основы химии природных соединений. Т. 2. — М.: ICSPF, 2009. — ISBN 978-5-903078-13-4о книге
- Гринкевич Н. И., Сафронич Л. Н. Химический анализ лекарственных растений: Учеб. пособие для фармацевтических вузов. — М.: 1983. — 176 с.о книге
- Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: Elsevier, 2007. — 335 с. — ISBN 978-0-444-52736-3о книге
- Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — 414 с. — ISBN 978-3-906390-24-6о книге
- E. Fattorusso and O. Taglialatela-Scafati. Modern Alkaloids: Structure, Isolation, Synthesis and Biology. — Wiley-VCH, 2008. — 691 с. — ISBN 978-3-527-31521-5о книге
- Tadhg P. Begley. Encyclopedia of Chemical Biology. — Wiley, 2009. — 3188 с. — ISBN 978-0-471-75477-0о книге
- Paul M Dewick. Medicinal Natural Products. A Biosynthetic Approach. Second Edition. — Wiley, 2002. — 515 с. — ISBN 0471496405о книге
| Основные группы биохимических молекул | |
|---|---|
| Основные группы биохимических молекул | Пептиды • Белки (вещества) • G-белки • Углеводы Нуклеотиды • Нуклеиновые кислоты • Липиды • ТерпеныКаротиноиды • Стероиды • Флавоноиды • Алкалоиды • Гликозиды |
| ∘ ∘ ∘ Также смотри: Рецептор (биохимия), Рецептор (физиология) ∘ ∘ ∘ | |