Соляная кислота
Соля́ная кислота (хлороводоро́дная кислота) — раствор хлористого водорода в воде; сильная одноосновная кислота. Бесцветная, «дымящая» на воздухе, сильно едкая жидкость (техническая соляная кислота нередко желтоватая, из-за примесей ионов Fe и др.). Максимальная концентрация при 20 °C равна 38 % по массе, плотность такого раствора 1,19 г/см3.
Слабые растворы соляной кислоты (до 0,4%) имеют специфический терпко-кислый вкус, более концентрированные вызывают денатурацию белков и ожоги полости рта. Соли соляной кислоты называются хлоридами.
Физические свойства[править | править код]
Физические свойства растворов соляной кислоты разных концентраций приведены в таблице:
| Конц. (вес) c : кг HCl/кг |
Конц. (г/л) c : кг HCl/м³ |
Плотность ρ : кг/л |
Молярность M |
pH |
Вязкость η : мПа·с |
Удельная теплоемкость s : кДж/(кг·К) |
Давление пара PHCl : Па |
Т кипения т.кип. |
Т плавления т.пл. |
| 10 % | 104,80 | 1,048 | 2,87 M | −0,5 | 1,16 | 3,47 | 0,527 | 103 °C | −18 °C |
| 20 % | 219,60 | 1,098 | 6,02 M | −0,8 | 1,37 | 2,99 | 27,3 | 108 °C | −59 °C |
| 30 % | 344,70 | 1,149 | 9,45 M | −1,0 | 1,70 | 2,60 | 1,410 | 90 °C | −52 °C |
| 32 % | 370,88 | 1,159 | 10,17 M | −1,0 | 1,80 | 2,55 | 3,130 | 84 °C | −43 °C |
| 34 % | 397,46 | 1,169 | 10,90 M | −1,0 | 1,90 | 2,50 | 6,733 | 71 °C | −36 °C |
| 36 % | 424,44 | 1,179 | 11,64 M | −1,1 | 1,99 | 2,46 | 14,100 | 61 °C | −30 °C |
| 38 % | 451,82 | 1,189 | 12,39 M | −1,1 | 2,10 | 2,43 | 28,000 | 48 °C | −26 °C |
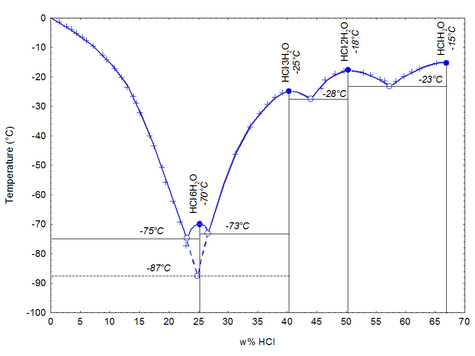
При затвердевании даёт кристаллогидраты составов HCl·H2O, HCl·2H2O, HCl·3H2O, HCl·6H2O.
Химические свойства[править | править код]
Соляная кислота представляет собой типичную сильную одноосновную кислоту.
В водных растворах диссоциирует практически полностью (константа диссоциации 1·107): HCl + H2O ⇄ H3O+ + Cl-
- реагирует с металлами, стоящими в электрохимическом ряду металлов до водорода,
- с оксидами металлов (если образуется растворимая соль),
- с гидроксидами металлов (если образуется растворимая соль),
- с солями металлов, образованных более слабыми кислотами (напр. угольной),
- с сильными окислителями (перманганат калия, диоксид марганца), выделяя хлор.
Производство[править | править код]
Соляную кислоту получают растворением газообразного хлороводорода в воде. Последний может быть получен действием концентрированной серной кислоты на хлорид натрия, либо сжиганием водорода в хлоре.
Применение[править | править код]
Как сильная кислота, образующая множество хорошо растворимых солей, широко применяется в технике и научных исследованиях.
- Применяют в гидрометаллургии и гальванопластике, для очистки поверхности металлов при паянии и лужении, для получения хлоридов цинка, марганца, железа и др. металлов. В смеси с ПАВ используется для очистки керамических и металлических изделий (тут необходима ингибированная кислота) от загрязнений и дезинфекции.
- Составная часть желудочного сока; разведенную соляную кислоту назначают внутрь главным образом при заболеваниях, связанных с недостаточной кислотностью желудочного сока.
- В пищевой промышленности: содовая вода производится путём добавления очищенной соляной кислоты к раствору гидрокарбоната натрия (питьевой соды).
Токсикология и особенности обращения[править | править код]
Соляная кислота — едкое вещество, при попадании на кожу вызывает сильные ожоги. Особенно опасно попадание в глаза. При обычных условиях соляная кислота образует пары хлороводорода, который разъедает слизистые оболочки и дыхательные пути. Реагируя с такими веществами, как хлорная известь или перманганат калия, образует токсичный газ хлор.